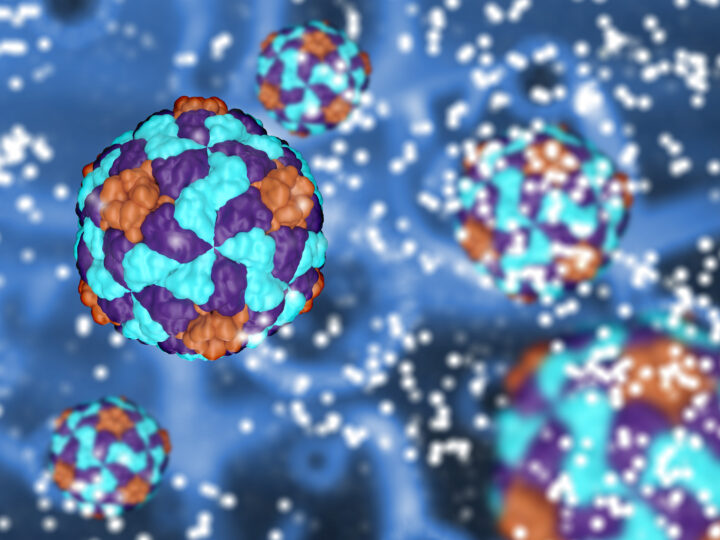
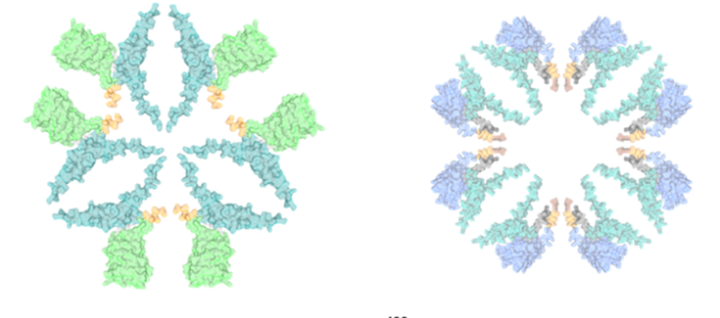
Un equipo de investigadores de la Universitat Politècnica de València (UPV), el CIBER-BBN y la Universidad de Edimburgo ha desarrollado […]
Tag: Nanopartículas
La Universidad de Sevilla y el SAS solicitan una patente para un nuevo tratamiento del tromboembolismo venoso mediante nanomedicina
El Grupo I+DNanoMed presenta una innovadora patente en nanomedicina para tratar enfermedad tromboembólica venosa. El grupo de investigación I+DNanoMed de […]
Nanorrobots contra el cáncer de vejiga consiguen reducir tumores en un 90%
Un estudio publicado en la prestigiosa revista Nature Nanotechnology muestra cómo un equipo de investigación ha sido capaz de reducir en un […]
Nanopartículas que detectan y destruyen selectivamente fibroblastos asociados a tumores
Un equipo de investigadores del CIBER-BBN ha desarrollado unas nanopartículas proteicas que llevan un ligando capaz de reconocer y unirse […]
La unión de medicamentos con lípidos podría mejorar la eficacia de los fármacos
Investigadores de las universidades de Navarra y Paris-Saclay han creado una estrategia innovadora uniendo profármacos con lípidos nanoestructurados. Esta técnica […]
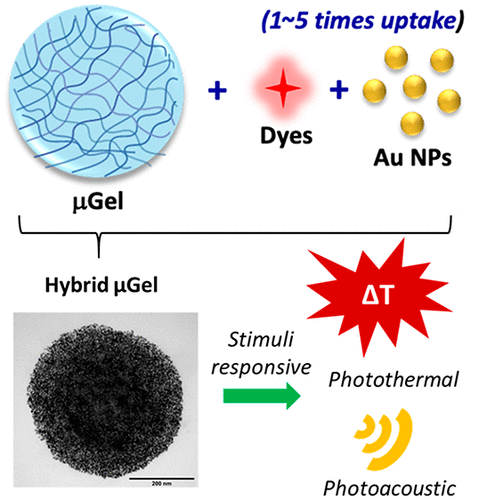
Investigadores de la Universidad de Jaén desarrollan microgeles de oro para tratamientos personalizados con menos efectos secundarios
Investigadores de la Universidad de Jaén han desarrollado microgeles con nanopartículas de oro que tienen la capacidad de transportar fármacos […]
Los nanorrobots de BLADDEBOTS llegan a las aulas a través del proyecto de divulgación Nanoinventum
BLADDEBOTS es un proyecto liderado por el investigador del IBEC Samuel Sánchez, enfocado en el diseño de nanorrobots para tratar […]
Físicos de la UGR desarrollan unos microgeles con nanopartículas de oro que permiten diagnosticar y tratar tumores
Un equipo internacional de científicos, incluyendo un físico de la Universidad de Granada (UGR), ha desarrollado microgeles con nanopartículas de […]
Desarrollan vacuna personalizada para combatir el cáncer de pulmón
El Grupo de Ingeniería de Materiales – GEMAT de IQS, liderado por la Dra. Cristina Fornaguera, encabeza el proyecto europeo […]
El Hospital de La Princesa participa en un proyecto contra el melanoma usando nanopartículas
El proyecto de inmunoterapia contra el melanoma liderado por el Centro Nacional de Investigaciones Oncológicas (CNIO), liderado por Héctr Peinado, […]