La macroencapsulación celular ha demostrado un gran potencial para superar la baja supervivencia de los islotes pancreáticos trasplantados en las terapias para la diabetes mellitus tipo 1. Además, sus propiedades superficiales parecen claves para que el implante sea exitoso. En esta línea, investigadores del grupo NanoBioCel, que lidera José Luis Pedráz en elCIBER-BBN y la UPV/EHU, analizan nuevos sistemas de macroencapsulación de células beta que combina un hidrogel de alginato inyectable con un dispositivo implantable externo impreso en 3D.
Este trabajo, que forma parte de la tesis doctoral del investigador Albert Espona-Noguera, se centra en el desarrollo de una macrocápsula externa que protege a las células beta que se encuentran embebidas en el hidrogel interno, y al mismo tiempo que permite la ubicación precisa del implante en el cuerpo. Además, este sistema de encapsulación celular permite la extracción de una manera sencilla de los injertos en caso de que el implante falle o se requiera la renovación de las células terapéuticas. El estudio ha sido impulsado por la Unidad de Formulación de Medicamentos de la ICTS Nanbiosis, del grupo de José Luis Pedraz, en colaboración con el Instituto de Microelectrónica de Barcelona (IMB-CNM, CSIC) también perteneciente al CIBER-BBN.
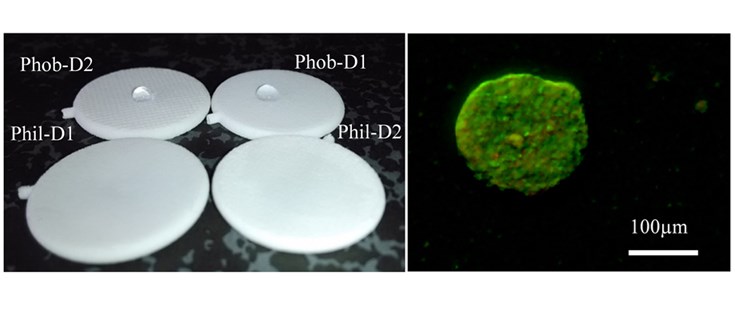
Según explica José Luis Pedraz, “en este estudio evaluamos el efecto biológico de la superficie de los dispositivos de macroencapsulación (hidrofilicidad y porosidad) en cuatro sistemas distintos. Dichos dispositivos fueron capaces de contener con éxito células beta de rata integradas en hidrogeles de alginato, y aunque todos ellos mostraron una gran biocompatibilidad, la baja adhesión celular en la superficie de los hidrófobos podría reducir la respuesta inmunológica al implantarse”.
En este estudio, las células beta encapsuladas dentro de todos los dispositivos mantuvieron su función secretora de insulina pero sin embargo el dispositivo hidrófobo con un tamaño de poro más pequeño mostró mejores valores de viabilidad celular y, por lo tanto, podría ser el mejor candidato para el desarrollo de una terapia de reemplazo de células beta seguras en pacientes de diabetes mellitus tipo 1.
Proporciona una matriz de apoyo inmunoprotectora
En este sistema, el hidrogel de alginato proporciona una matriz de apoyo inmunoprotectora donde las células beta permanecen integradas, mientras que el dispositivo de macroencapsulación semipermeable confiere protección mecánica, así como un fácil manejo y recuperación. Según explica el jefe de grupo del CIBER-BBN, José Luis Pedraz, “nuestro objetivo era lograr un dispositivo de macroencapsulación no degradable, con una superficie funcional y biocompatible, capaz de estabilizar el hidrogel de alginato interno, garantizando la bioseguridad del sistema y proporcionando inmunoprotección. Además, el sistema de doble encapsulación debe garantizar la difusión apropiada de oxígeno, nutrientes y hormonas como la insulina, mientras que se mantiene la viabilidad y función biológica de las células beta”.
Una terapia prometedora para restablecer la producción de insulina
La diabetes mellitus tipo 1 es una enfermedad autoinmune caracterizada por la deficiencia de insulina causada por la destrucción específica de las células pancreáticas, que provoca niveles altos de glucosa en sangre. El trasplante de islotes pancreáticos es una terapia prometedora para restablecer la producción de insulina regulada naturalmente y restaurar la función celular en pacientes diabéticos y en este sentido, la encapsulación celular se ha convertido en un enfoque prometedor para superar los problemas de trasplante al eliminar la necesidad de inmunosupresión, debido a la introducción de una barrera física entre las células implantadas y el receptor.
El trasplante de islotes pancreáticos se realiza en la vena porta, donde se pueden perder muchos islotes. Sin embargo, los dispositivos de macroencapsulación evitarían esta pérdida, a la vez que permitirían una fácil recuperación del injerto y la reposición de islotes si fuera necesario, y se basan en cámaras extravasculares que incluyen membranas porosas que permiten bloquear los agentes inmunitarios.
La entrada de suficiente oxígeno dentro de este tipo de dispositivos requiere la difusión desde los vasos sanguíneos circundantes hasta el dispositivo a través de la membrana y, a continuación, a través del interior del dispositivo hacia las células.
Fuente: CIBER
Artículo de referencia: Albert Espona-Noguera, Jesús Ciriza, Alberto Cañibano-Hernández, Rosa Villa, Laura Saenz del Burgo, Mar Álvarez, José Luis Pedraz. 3D printed polyamide macroencapsulation devices combined with alginate hydrogels for insulin-producing cell-based therapies. https://doi.org/10.1016/j.ijpharm.2019.06.009
